Eric Bergeron ,
Suzanne Benjannet ,
Bobbie R Erickson ,
Pierre E Rollin ,
Thomas G Ksiazek ,
Nabil G Seidah e
Stuart T Nichol
Virology Journal volume 2 , Artigo número: 69 ( 2005 ) Citar este artigo
Traduçâo: Ricardo Camillo 01/09/2020
Obs. por se tratar de um artigo muito longo tradução automática sem correção.
Resumo
fundo
A síndrome respiratória aguda grave (SARS) é causada por um coronavírus recém-descoberto (SARS-CoV). Nenhuma terapia profilática ou pós-exposição eficaz está disponível atualmente.
Resultados
No entanto, relatamos que a cloroquina tem fortes efeitos antivirais na infecção por SARS-CoV de células de primatas. Esses efeitos inibitórios são observados quando as células são tratadas com a droga antes ou depois da exposição ao vírus, sugerindo vantagem profilática e terapêutica. Além das funções bem conhecidas da cloroquina, como elevações do pH endossomal, a droga parece interferir na glicosilação terminal do receptor celular, a enzima conversora de angiotensina 2. Isso pode influenciar negativamente a ligação do vírus-receptor e anular a infecção, com outras ramificações pela elevação do pH vesicular, resultando na inibição da infecção e disseminação do SARS CoV em concentrações clinicamente admissíveis.
Conclusão
A cloroquina é eficaz na prevenção da propagação do SARS CoV em cultura de células. A inibição favorável da propagação do vírus foi observada quando as células foram tratadas com cloroquina antes ou após a infecção por SARS CoV. Além disso, o ensaio de imunofluorescência indireta aqui descrito representa um método simples e rápido para a triagem de compostos antivirais SARS-CoV.
fundo
A síndrome respiratória aguda grave (SARS) é uma doença emergente que foi relatada pela primeira vez na província de Guangdong, China, no final de 2002. A doença se espalhou rapidamente para pelo menos 30 países poucos meses após seu primeiro aparecimento, e esforços mundiais combinados levaram à identificação de o agente etiológico como coronavírus SARS (SARS-CoV), um novo membro da família Coronaviridae [ 1 ]. O sequenciamento completo do genoma do SARS-CoV [ 2 , 3 ] confirmou que esse patógeno não está intimamente relacionado a nenhum dos grupos de coronavírus previamente estabelecidos. O brotamento do SARS-CoV ocorre no aparelho de Golgi [ 4] e resulta na incorporação da glicoproteína do pico do envelope no vírion. A glicoproteína de pico é uma proteína de membrana do tipo I que facilita a ligação viral ao receptor celular e o início da infecção, e a enzima conversora de angiotensina-2 (ACE2) foi identificada como um receptor celular funcional de SARS-CoV [ 5 ]. Recentemente, mostramos que o processamento da proteína spike foi efetuado por converttases semelhantes à furina e que a inibição dessa clivagem por um inibidor específico anulou a citopatia e reduziu significativamente o título do vírus de SARS-CoV [ 6 ].
Devido à gravidade da infecção por SARS-CoV, o potencial de disseminação rápida da doença e a ausência de inibidores in vivo comprovadamente eficazes e seguros do vírus, é importante identificar medicamentos que podem ser usados com eficácia para tratar ou prevenir potenciais Infecções por SARS-CoV. Muitas novas abordagens terapêuticas foram avaliadas em estudos de laboratório de SARS-CoV: notáveis entre essas abordagens são aquelas que usam siRNA [ 7 ], transferência passiva de anticorpos [ 8 ], vacinação de DNA [ 9 ], vaccinia ou vírus parainfluenza expressando a proteína spike [ 10] , 11 ], interferões [ 12 , 13], e anticorpo monoclonal para a subunidade S1 da glicoproteína de pico que bloqueia a ligação ao receptor [ 14] Neste relatório, descrevemos a identificação da cloroquina como um agente antiviral pré e pós-infecção eficaz para SARS-CoV. A cloroquina, uma 9-aminoquinolina identificada em 1934, é uma base fraca que aumenta o pH das vesículas ácidas. Quando adicionada extracelularmente, a porção não protonada da cloroquina entra na célula, onde se torna protonada e concentrada em organelas ácidas de baixo pH, como endossomos, vesículas de Golgi e lisossomas. A cloroquina pode afetar a infecção pelo vírus de várias maneiras, e o efeito antiviral depende em parte da extensão em que o vírus utiliza os endossomos para a entrada. A cloroquina tem sido amplamente utilizada para tratar doenças humanas, como malária, amebiose, HIV e doenças autoimunes, sem efeitos colaterais prejudiciais significativos [ 15] Junto com os dados apresentados aqui, mostrando a inibição do vírus em cultura de células por doses de cloroquina compatíveis com o tratamento do paciente, essas características sugerem que uma avaliação mais aprofundada da cloroquina em modelos animais de infecção por SARS-CoV seria garantida à medida que progredimos para encontrar antivirais eficazes para prevenção ou tratamento da doença.
Resultados
O tratamento pré-infecção com cloroquina torna as células Vero E6 refratárias à infecção por SARS-CoV
A fim de investigar se a cloroquina pode prevenir a infecção por SARS-CoV, células Vero E6 permissivas [ 1 ] foram pré-tratadas com várias concentrações de cloroquina (0,1–10 μM) por 20–24 h antes da infecção do vírus. As células foram então infectadas com SARS-CoV e os antígenos do vírus foram visualizados por imunofluorescência indireta, conforme descrito em Materiais e Métodos. Exame microscópico (Fig. 1A) das células de controle (não tratadas, infectadas) revelaram extensa imunomarcação específica para SARS-CoV da monocamada. Uma diminuição dependente da dose nas células positivas para o antígeno do vírus foi observada a partir de 0,1 μM de cloroquina, e concentrações de 10 μM aboliram completamente a infecção por SARS-CoV. Para fins quantitativos, contamos o número de células com coloração positiva em três locais aleatórios em uma lâmina. O número médio de células de controle coradas positivamente foi classificado como 100% e foi comparado com o número de células positivas observadas em várias concentrações de cloroquina (Fig. 1B) O pré-tratamento com 0,1, 1 e 10 μM de cloroquina reduziu a infectividade em 28%, 53% e 100%, respectivamente. Resultados reproduzíveis foram obtidos a partir de três experiências independentes. Esses dados demonstraram que o pré-tratamento de células Vero E6 com cloroquina tornou essas células refratárias à infecção por SARS-CoV.
figura 1
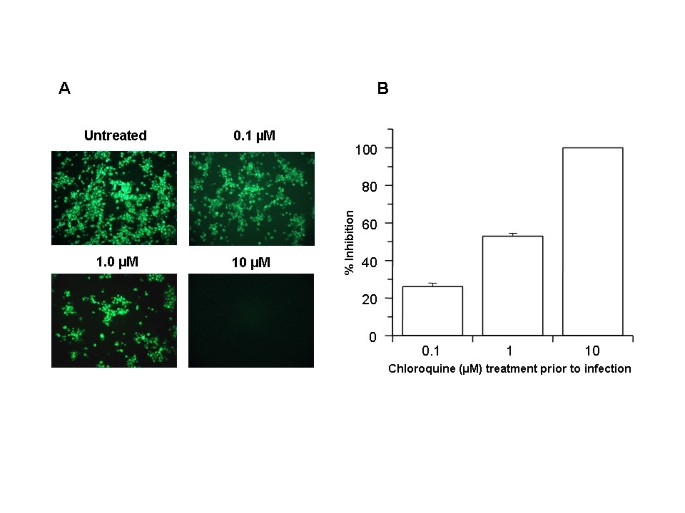
Efeito profilático da cloroquina . Células Vero E6 pré-tratadas com cloroquina por 20 horas. Os meios contendo cloroquina foram removidos e as células foram lavadas com solução salina tamponada com fosfato antes de serem infectadas com SARS-CoV (0,5 multiplicidade de infecção) por 1 h. na ausência de cloroquina. O vírus foi então removido e as células foram mantidas em Opti-MEM (Invitrogen) por 16–18 h na ausência de cloroquina. Os antígenos SARS-CoV foram corados com HMAF específico para vírus, seguido por anticorpos secundários conjugados com FITC. (A) A concentração de cloroquina usada é indicada no topo de cada painel. (B)Células positivas para o antígeno SARS-CoV em três locais aleatórios foram capturadas usando uma câmera digital, o número de células positivas para o antígeno foi determinado e a inibição média foi calculada. A inibição percentual foi obtida considerando o controle não tratado como 0% de inibição. As barras verticais representam o intervalo de SEM.
Imagem em tamanho real
O tratamento com cloroquina pós-infecção é eficaz na prevenção da disseminação da infecção por SARS-CoV
A fim de investigar as propriedades antivirais da cloroquina no SARS-CoV após o início da infecção, células Vero E6 foram infectadas com o vírus e meio fresco suplementado com várias concentrações de cloroquina foi adicionado imediatamente após a adsorção do vírus. As células infectadas foram incubadas por mais 16–18 h, após as quais a presença de antígenos virais foi analisada por análise de imunofluorescência indireta. Quando a cloroquina foi adicionada após o início da infecção, houve uma diminuição dramática dependente da dose no número de células positivas para o antígeno do vírus (Fig. 2A ). Tão pouco quanto 0,1-1 μM de cloroquina reduziu a infecção em 50% e até 90-94% de inibição foi observada com concentrações de 33-100 μM (Fig. 2B) Em concentrações de cloroquina superiores a 1 μM, apenas um pequeno número de células individuais foi inicialmente infectado e a disseminação da infecção para as células adjacentes foi praticamente eliminada. A metade do efeito inibitório máximo foi estimada para ocorrer em 4,4 ± 1,0 μM de cloroquina (Fig. 2C ). Esses dados mostram claramente que a adição de cloroquina pode reduzir efetivamente o estabelecimento da infecção e a disseminação do SARS-CoV se a droga for adicionada imediatamente após a adsorção do vírus.
Figura 2
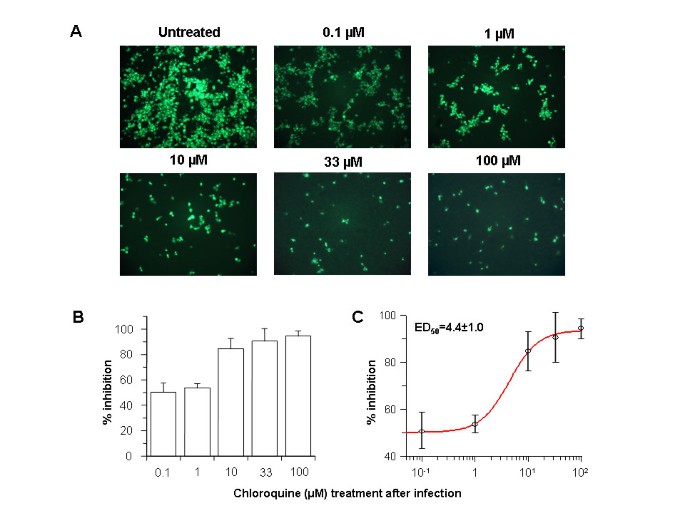
O tratamento com cloroquina pós-infecção reduz a infecção e disseminação da SARS-CoV . As células Vero E6 foram semeadas e infectadas como descrito para a Fig. 1, exceto que a cloroquina foi adicionada apenas após a adsorção do vírus. As células foram mantidas em Opti-MEM (Invitrogen) contendo cloroquina por 16–18 h, após as quais foram processadas para imunofluorescência. (A) A concentração de cloroquina é indicada na parte superior. (B) A inibição percentual e SEM foram calculados como na Fig. 1B. (C) A dose eficaz (ED 50 ) foi calculada utilizando o software comercialmente disponível (Grafit, versão 4, Erithacus Software).
Imagem em tamanho real
A análise de microscopia eletrônica indicou o aparecimento de quantidades significativas de partículas virais extracelulares 5–6 h após a infecção [ 16 ]. Uma vez que observamos os efeitos antivirais da cloroquina imediatamente após a adsorção do vírus, estendemos ainda mais a análise adicionando cloroquina 3 e 5 h após a adsorção do vírus e examinamos a presença de antígenos do vírus após 20 h. Descobrimos que a cloroquina ainda era significativamente eficaz, mesmo quando adicionada 5 horas após a infecção (Fig. 3 ); entretanto, para obter efeito antiviral equivalente, uma concentração maior de cloroquina era necessária se a droga fosse adicionada 3 ou 5 horas após a adsorção.
Figura 3
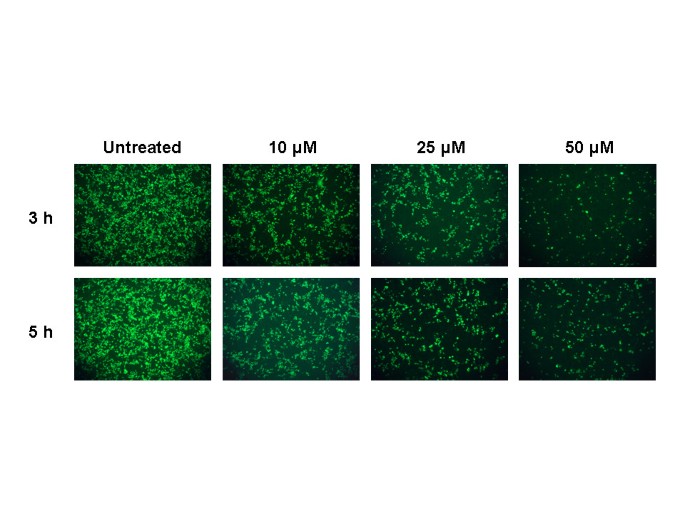
Tratamento pós-infecção cronometrado com cloroquina . Este experimento é semelhante ao representado na Fig. 2, exceto que as células foram infectadas em 1 multiplicidade de infecção e cloroquina (10, 25 e 50 μM) foi adicionada 3 ou 5 h após a infecção.
Imagem em tamanho real
Cloreto de amônio inibe a infecção por SARS-CoV de células Vero E6
Uma vez que a cloroquina inibiu a infecção por SARS-CoV quando adicionada antes ou após a infecção, formulamos a hipótese de que outro agente lisosomotrópico comum, o NH 4 Cl, também pode funcionar de maneira semelhante. O cloreto de amônio tem sido amplamente utilizado em estudos que abordam a entrada de vírus mediada por endossomo. Coincidentemente, o NH 4 Cl foi recentemente mostrado para reduzir a transdução de vírus de pseudótipo decorados com a proteína spike SARS-CoV [ 17 , 18 ]. Em uma tentativa de examinar se NH 4 Cl funciona de forma semelhante à cloroquina, realizamos análises de infecção em células Vero E6 antes (Fig. 4A ) e depois (Fig. 4B ) de serem tratadas com várias concentrações de NH 4Cl. Em ambos os casos, observamos uma inibição de 93-99% com NH 4 Cl a ≥ 5 mM. Estes dados indicaram que o NH 4 Cl (≥ 5 mM) e a cloroquina (≥ 10 μM) são muito eficazes na redução da infecção por SARS-CoV. Esses resultados sugerem que os efeitos da cloroquina e do NH 4 Cl no controle da infecção e disseminação do SARS CoV podem ser mediados por mecanismo (s) semelhante (s).
Figura 4
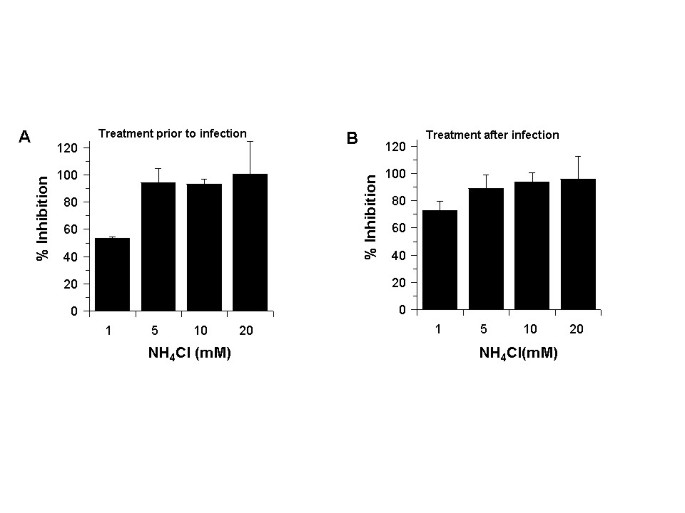
O NH 4 Cl inibe a SARS-CoV durante o tratamento pré ou pós-infecção . NH 4 Cl foi adicionado às células antes (A) ou após (B) a infecção, semelhante ao que foi feito para a cloroquina nas Figs. 1 e 2. As células positivas para o antígeno foram contadas e os resultados foram apresentados como na Fig. 1B .
Imagem em tamanho real
Efeito da cloroquina e NH 4 Cl na expressão da superfície celular de ACE2
Realizamos experimentos adicionais para elucidar o mecanismo de inibição da SARS-CoV pela cloroquina e pelo NH 4 Cl. Uma vez que o pH ácido intra-vesicular regula as funções celulares, incluindo corte de N-glicosilação, tráfego celular e várias atividades enzimáticas, era de interesse caracterizar o efeito de ambas as drogas no processamento, glicosilação e classificação celular da glicoproteína de pico SARS-CoV e seu receptor, ACE2. A análise de citometria de fluxo foi realizada em células Vero E6 que não foram tratadas ou foram tratadas com concentrações anti-SARS-CoV altamente eficazes de cloroquina ou NH 4Cl. Os resultados revelaram que nenhuma das drogas causou uma mudança significativa nos níveis de ACE2 da superfície celular, indicando que os efeitos inibitórios observados na infecção por SARS-CoV não são devidos à falta de ACE2 disponível na superfície celular (Fig. 5A ). Em seguida, analisamos as formas moleculares de ACE2 endógeno em células Vero E6 não tratadas e em células que foram pré-incubadas por 1 h com várias concentrações de NH 4 Cl (2,5–10 mM) ou cloroquina (1 e 10 μM) e marcadas com 35 S- (Met) por 3 h na presença ou ausência dos medicamentos (Fig. 5B e 5C ). Em condições normais, observamos duas formas de ACE2 imunorreativas, migrando a ~ 105 e ~ 113 kDa, respectivamente (Fig. 5B, pista 1). A proteína de ~ 105 kDa é sensível à endoglicosidase H, sugerindo que ela representa a forma localizada do retículo endoplasmático (ER), enquanto a proteína de ~ 113 kDa é resistente à endoglicosidase H e representa a forma modificada por Golgi de ACE2 [ 19 ]. A especificidade do anticorpo foi confirmada pelo deslocamento das bandas de proteína imunorreativa com excesso de ACE2 humano recombinante solúvel em frio (+ rhACE2; Fig. 5B , faixa 2). Quando analisamos as formas de ACE2 na presença de NH 4 Cl, um claro aumento gradual na migração da proteína ~ 113-kDa foi observado com concentrações crescentes de NH 4 Cl, com um efeito máximo observado em NH 4 Cl 10 mM , resultando em apenas a forma ER de ACE2 sendo visível no gel (Fig.5B , compare as pistas 3-5). Isto sugeriu que o corte e / ou modificações terminais das cadeias N-glicosiladas de ACE2 foram afetadas pelo tratamento com NH 4 Cl. Além disso, em NH 4 Cl 10 mM , a forma ER de ACE2 migrou com mobilidade ligeiramente mais rápida, indicando que NH 4 Cl nessa concentração também pode afetar a glicosilação do núcleo. Também examinamos o estado de glicosilação terminal de ACE2 quando as células foram tratadas com cloroquina (Fig. 5C ). Semelhante ao NH 4Cl, um aumento gradual na mobilidade eletroforética de ACE2 foi observado com concentrações crescentes de cloroquina. A 25 μM de cloroquina, a mobilidade eletroforética mais rápida da forma modificada por Golgi de ACE2 foi claramente evidente. Com base na citometria de fluxo e nas análises de imunoprecipitação, pode-se inferir que o NH 4 Cl e a cloroquina prejudicaram a glicosilação terminal de ACE2, enquanto o NH 4 Cl resultou em um efeito mais dramático. Embora ACE2 seja expresso em quantidades semelhantes na superfície celular, as variações em seu estado de glicosilação podem tornar a interação ACE2-SARS-CoV menos eficiente e inibir a entrada do vírus quando as células são tratadas com NH 4 Cl e cloroquina.
Figura 5
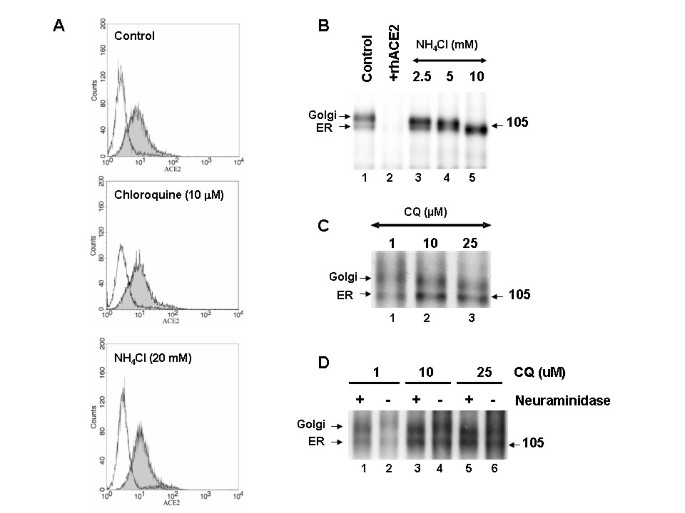
Efeito de agentes lisomotrópicos na expressão da superfície celular e na biossíntese de ACE2 . (A) As células Vero E6 foram cultivadas por 20 h na ausência (controle) ou na presença de cloroquina (10 μM) ou NH 4 Cl (20 mM). As células foram marcadas com anti-ACE2 (histograma cinza) ou com um anticorpo secundário sozinho (histograma branco). (B) Biossíntese de ACE2 em células não tratadas ou em células tratadas com NH 4 Cl. As células Vero E6 foram marcadas com pulso por 3 h com 35S-Met e os lisados celulares foram imunoprecipitados com um anticorpo ACE2 (faixa 1). A pré-incubação do anticorpo com ACE2 humano recombinante (rhACE2) aboliu completamente o sinal (faixa 2). As posições da forma ER sensível à endoglicosidase H e da forma Golgi resistente à endoglicosidase H de ACE2 são enfatizadas. Observe que o aumento da concentração de NH 4 Cl resulta na diminuição da forma Golgi de ACE2. (C) Um experimento semelhante foi realizado na presença das concentrações indicadas de cloroquina. Observe a perda de glicanos terminais com concentrações crescentes de cloroquina. (D)A modificação glicosídica terminal de ACE2 foi avaliada por tratamento com neuraminidase de ACE2 imunoprecipitado. Aqui, as células foram tratadas com concentrações de 1–25 μM de cloroquina durante a fome, pulso e perseguição de 3 horas.
Imagem em tamanho real
Para confirmar que ACE2 sofre modificações terminais de açúcar e que a glicosilação terminal é afetada por NH 4 Cl ou tratamento com cloroquina, realizamos imunopreipitação de ACE2 marcado com 35 S e submetemos os imunoprecipitados à digestão por neuraminidase. As proteínas foram resolvidas usando SDS-PAGE (Fig 5D ). É evidente a partir da mobilidade ligeiramente mais rápida da forma Golgi de ACE2 após o tratamento com neuraminidase (Fig 5D , compare as pistas 1 e 2), que ACE2 sofre glicosilação terminal; no entanto, a forma ER de ACE2 não foi afetada pela neuraminidase. As células tratadas com 10 μM de cloroquina não resultaram em uma mudança significativa; enquanto que 25 μM de cloroquina fez com que a forma Golgi de ACE2 se resolvesse de maneira semelhante à ACE2 tratada com neuraminidase (Fig.5D , compare as pistas 5 e 6). Esses dados fornecem evidências de que ACE2 sofre glicosilação terminal e que a cloroquina em concentrações de anti-SARS-CoV anula o processo.
Efeito da cloroquina e NH 4 Cl na biossíntese e processamento da proteína spike SARS-CoV
Em seguida, abordamos se as drogas lisossomotrópicas (NH 4 Cl e cloroquina) afetam a biossíntese, glicosilação e / ou tráfego da glicoproteína de pico SARS-CoV. Para tanto, células Vero E6 foram infectadas com SARS-CoV por 18 h. Cloroquina ou cloreto de amônio foi adicionado a essas células durante o período de privação (1 h), marcado (30 min) ou perseguido (3 h). Os lisados celulares foram analisados por imunoprecipitação com o anticorpo policlonal específico para SARS (HMAF). Os resultados de pulso de 30 min indicaram que o pró-pico (proS) foi sintetizado como um precursor de ~ 190 kDa (proS-ER) e processado em proteínas ~ 125, ~ 105 e ~ 80 kDa (Fig. 6A , pista 2), um resultado idêntico ao de nossa análise anterior [ 6 ]. Exceto para a cloroquina 100 μM (Fig.6A , faixa 3), não houve diferença significativa na biossíntese ou processamento da proteína spike do vírus em células não tratadas ou tratadas com cloroquina (Fig. 6A , faixas 4-6). Deve-se notar que a cloroquina a 100 μM resultou em uma diminuição geral na biossíntese e nos níveis de glicoproteína viral processada. Em vista da falta de redução na biossíntese e processamento da glicoproteína de pico na presença de concentrações de cloroquina (10 e 50 μM) que causaram grandes reduções na replicação e disseminação do SARS-CoV, concluímos que o efeito antiviral provavelmente não é devido à alteração da biossíntese e processamento da glicoproteína viral. Análises semelhantes foram realizadas com NH 4Cl, e os dados sugeriram que a biossíntese e o processamento da proteína spike também não foram afetados negativamente pelo NH 4 Cl (Fig. 6A , pistas 7-12). Consistente com nossa análise anterior [ 6 ], observamos a presença de uma proteína maior, que é referida aqui como oligômeros. Recentemente, Song et al. [ 20 ] forneceram evidências de que estes são homotrímeros da proteína spike SARS-CoV e foram incorporados aos vírions. Curiosamente, os níveis dos homotrímeros nas células tratadas com 100 μM de cloroquina e 40 e 20 mM de NH 4 Cl (Fig. 6A , pistas 3, 9 e 10) foram ligeiramente mais baixos do que nas células de controle ou células tratadas com concentrações de drogas mais baixas.
Figura 6
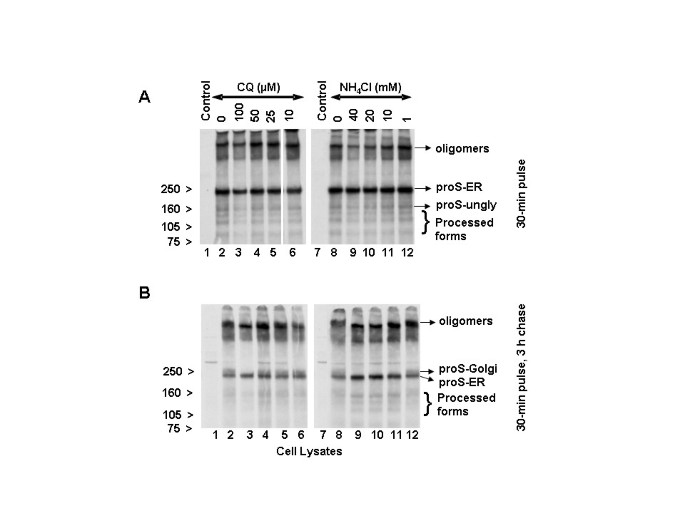
Efeitos do NH 4 Cl e da cloroquina (CQ) na biossíntese, processamento e glicosilação da proteína spike SARS-CoV . As células Vero E6 foram infectadas com SARS-CoV conforme descrito na Fig. 2. CQ ou NH 4 Cl foi adicionado durante os períodos de privação (1 h) e marcação (30 min) com 35 S-Cys e seguido de perseguição por 3 h na presença de meio não marcado. As células foram lisadas em tampão RIPA e imunoprecipitadas com HMAF. As proteínas do vírus foram resolvidas usando gel NuPAGE 3–8% (Invitrogen). As células apresentadas foram marcadas por 30 min (A) e perseguidas por 3 h (B) . As posições de migração das várias formas moleculares de pico são indicadas no lado direito, e as dos padrões moleculares são mostradas no lado esquerdo. proS-ER e proS-Golgi são os pró-pico de SARS-Co nos compartimentos ER e Golgi, respectivamente, e proS-ungly é o pró-pico ER não glicosilado.
Imagem em tamanho real
Os dados obtidos a partir de um pulso de 30 min seguido por uma perseguição de 3 h (Fig. 6B , pistas 2 e 8) confirmaram nossa observação anterior de que o precursor da proteína spike SARS-CoV (proS-ER) adquire modificações específicas de Golgi (proS -Golgi) resultando em uma proteína de ~ 210 kDa [ 6 ]. A cloroquina a 10, 25 e 50 μM não teve impacto negativo substancial sobre o aparecimento da forma de Golgi (Fig. 6B , compare a pista 2 com as pistas 4-6). Apenas a 100 μM de cloroquina foi observada uma redução no nível do pró-pico modificado por Golgi (faixa 3). Por outro lado, NH 4Cl anulou o aparecimento de formas modificadas por Golgi a ≥10 mM (compare a faixa 8 com 9-11) e teve um efeito mais suave a 1 mM (faixa 12). Esses dados demonstram claramente que a biossíntese e o processamento proteolítico da proteína spike SARS-CoV não são afetados nas doses de cloroquina (25 e 50 μM) e NH 4 Cl (1 mM) que causam efeitos inibidores do vírus. Além disso, com 40, 20 e 10 mM de NH 4 Cl, houve um aumento do acúmulo de proS-ER com uma diminuição concomitante na quantidade de oligômeros (Fig. 6B , pistas 9-11). Quando examinamos os homotrímeros, descobrimos que a cloroquina a 100 μM e o NH 4 Cl a 40 e 20 mM resultou em uma mobilidade ligeiramente mais rápida dos trímeros (Fig. 6B, pistas 3, 9 e 10), mas as doses mais baixas do medicamento, que exibiram efeitos antivirais significativos, não resultaram em diferenças apreciáveis. Esses dados sugerem que a proteína de pico intracelular recém-sintetizada pode não ser um alvo principal para a cloroquina e a ação antiviral do NH 4 Cl. A mobilidade mais rápida do trímero em certas concentrações mais altas dos fármacos pode ser devido ao efeito desses fármacos na glicosilação terminal dos trímeros.
Discussão
Identificamos a cloroquina como um agente antiviral eficaz para SARS-CoV em condições de cultura de células, conforme evidenciado por seu efeito inibitório quando a droga foi adicionada antes da infecção ou após o início e o estabelecimento da infecção. O fato de a cloroquina exercer um efeito antiviral durante as condições pré e pós-infecção sugere que é provável que tenha vantagens profiláticas e terapêuticas. Recentemente, Keyaerts et al. [ 21 ] relataram as propriedades antivirais da cloroquina e identificaram que a droga afeta a replicação do SARS-CoV em cultura de células, conforme evidenciado por RT-PCR quantitativo. Tomados em conjunto com os achados de Keyaerts et al. [ 21], nossa análise fornece evidências adicionais de que a cloroquina é eficaz contra as cepas SARS-CoV Frankfurt e Urbani. Fornecemos evidências de que a cloroquina é eficaz na prevenção da infecção por SARS-CoV em cultura de células se a droga for adicionada às células 24 horas antes da infecção. Além disso, a cloroquina foi significativamente eficaz mesmo quando a droga foi adicionada 3–5 h após a infecção, sugerindo um efeito antiviral mesmo após o estabelecimento da infecção. Uma vez que resultados semelhantes foram obtidos pelo tratamento com NH 4 Cl de células Vero E6, o (s) mecanismo (s) de ação subjacente (s) dessas drogas podem ser semelhantes.
Além do provável papel da cloroquina na replicação do SARS-CoV, os mecanismos de ação da cloroquina no SARS-CoV não são totalmente compreendidos. Estudos anteriores sugeriram a elevação do pH como um mecanismo pelo qual a cloroquina reduz a transdução de vírus do pseudótipo SARS-CoV [ 17 , 18 ]. Examinamos o efeito da cloroquina e NH 4 Cl nas proteínas de pico SARS-CoV e em seu receptor, ACE2. Os resultados de imunoprecipitação de ACE2 demonstraram claramente que as concentrações anti-SARS-CoV eficazes de cloroquina e NH 4Cl também prejudicou a glicosilação terminal de ACE2. No entanto, os dados de citometria de fluxo demonstraram que não há diferenças significativas na expressão da superfície celular de ACE2 em células tratadas com cloroquina ou NH 4 Cl. Com base nesses resultados, é razoável sugerir que o pré-tratamento com NH 4O Cl ou a cloroquina possivelmente resultou na expressão superficial do ACE2 subglicosilado. No caso do tratamento com cloroquina antes da infecção, o comprometimento da glicosilação terminal de ACE2 pode resultar em afinidades de ligação reduzidas entre ACE2 e proteína spike SARS-CoV e influenciar negativamente o início da infecção SARS-CoV. Uma vez que a biossíntese, processamento, modificação de Golgi e oligomerização da proteína spike recém-sintetizada não foram afetados de forma apreciável pelas concentrações de anti-SARS-CoV de cloroquina ou NH 4Cl, concluímos que esses eventos ocorrem na célula independentemente da presença das drogas. A contribuição potencial dessas drogas na elevação do pH endossomal e seu impacto na entrada ou saída subsequente do vírus não pode ser descartada. Uma diminuição na transdução do pseudótipo SARS-CoV na presença de NH 4 Cl foi observada e foi atribuída ao efeito no pH intracelular [ 17 , 18 ]. Quando cloroquina ou NH 4 Cl são adicionados após a infecção, esses agentes podem elevar rapidamente o pH e subverter os eventos de fusão em andamento entre o vírus e os endossomos, inibindo assim a infecção.
Além disso, o mecanismo de ação do NH 4 Cl e da cloroquina pode depender de quando foram adicionados às células. Quando adicionados após o início da infecção, esses medicamentos podem afetar a fusão mediada pelo endossomo, a replicação subsequente do vírus ou a montagem e liberação. Estudos anteriores da cloroquina demonstraram que ela tem múltiplos efeitos nas células de mamíferos, além da elevação do pH endossomal, incluindo a prevenção da glicosialização terminal de imunoglobulinas [ 22 ]. Quando adicionada às células infectadas por vírus, a cloroquina inibiu os estágios posteriores da maturação do vírus da estomatite vesicular ao inibir a expressão da glicoproteína na superfície celular [ 23], e inibiu a produção de partículas infecciosas de HIV-1 interferindo com a glicosilação terminal da glicoproteína [ 24 , 25 ]. Com base nessas propriedades, sugerimos que a expressão da superfície celular de ACE2 subglicosilada e sua baixa afinidade para a proteína spike SARS-CoV pode ser o mecanismo primário pelo qual a infecção é evitada pelo pré-tratamento com drogas das células antes da infecção. Por outro lado, a rápida elevação do pH endossomal e a anulação da fusão vírus-endossoma podem ser o mecanismo primário pelo qual a infecção por vírus é evitada em condições pós-tratamento. Serão realizados ensaios mais detalhados de ligação de SARS CoV spike-ACE2 na presença ou ausência de cloroquina para confirmar nossos achados. Nossos estudos indicam que o impacto do NH 4O Cl e a cloroquina no ACE2 e os perfis de proteína de pico são significativamente diferentes. NH 4 Cl exibe um efeito mais pronunciado do que a cloroquina na glicosilação terminal, destacando as novas e intrincadas diferenças entre a cloroquina e o cloreto de amônio em afetar o transporte de proteínas ou glicosilação da proteína spike SARS-CoV e seu receptor, ACE2, apesar de sua similaridade bem estabelecida efeitos da elevação do pH endossômico.
A infecciosidade de coronavírus diferentes do SARS-CoV também é afetada pela cloroquina, como exemplificado pelo CoV-229E humano [ 15 ]. Os efeitos inibitórios observados na infectividade do SARS-CoV e na disseminação celular ocorreram na presença de 1–10 μM de cloroquina, que são concentrações plasmáticas atingíveis durante a profilaxia e tratamento da malária (variando de 1,6–12,5 μM) [ 26 ] e, portanto, estão bem tolerado pelos pacientes. Especulou-se recentemente que a cloroquina pode ser eficaz contra a SARS e os autores sugeriram que este composto pode bloquear a produção de TNFα, IL6 ou IFNγ [ 15 ]. Nossos dados fornecem evidências para a possibilidade de usar a droga bem estabelecida cloroquina no manejo clínico da SARS.
Conclusão
A cloroquina, um medicamento relativamente seguro, eficaz e barato usado para tratar muitas doenças humanas, incluindo malária, amebiose e vírus da imunodeficiência humana, é eficaz na inibição da infecção e propagação do CoV da SARS em cultura de células. O fato de a droga ter efeito antiviral inibitório significativo quando as células suscetíveis foram tratadas antes ou depois da infecção sugere um possível uso profilático e terapêutico.
Métodos
Infecção por SARS-CoV, imunofluorescência e análises de imunoprecipitação
As células Vero E6 (uma linha celular de rim de macaco verde africano) foram infectadas com SARS-CoV (cepa Urbani) em uma multiplicidade de infecção de 0,5 por 1 h. As células foram lavadas com PBS e depois incubadas em meio OPTI-MEM (Invitrogen) com ou sem várias concentrações de cloroquina ou NH 4 Cl (ambos da Sigma). A coloração por imunofluorescência foi realizada com fluido ascítico hiperimune de camundongo específico para SARS-CoV (HMAF) [ 8 ] seguido por anticorpo anti-camundongo acoplado a fluoresceína.
Dezoito horas após a infecção, os sobrenadantes contendo vírus foram removidos e as células foram pulsadas com 35 S- (Cys) por 30 min e perseguidas por 3 h antes da lise em tampão RIPA. Os lisados celulares clarificados e os meios foram incubados com HMAF, e as proteínas imunoprecipitadas foram separadas por gel NuPAGE de 3–8% (Invitrogen); as proteínas foram visualizadas por autorradiografia. Em alguns experimentos, as células foram perseguidas por 3 h com meio isento de isótopos. Os sobrenadantes celulares clarificados também foram imunoprecipitados com HMAF específico para SARS-CoV.
Análise de citometria de fluxo ACE2 e biossíntese
As células Vero E6 foram semeadas em meio Eagle modificado por Dulbecco (Invitrogen) suplementado com soro fetal bovino a 10%. No dia seguinte, as células foram incubadas em Opti-MEM (Invitrogen) na presença ou ausência de 10 μM de cloroquina ou 20 mM de NH 4 Cl. Para analisar os níveis de ACE2 na superfície celular, as células foram incubadas em gelo com 10 μg / mL de anticorpo anti-ACE2 de cabra purificado por afinidade (R&D Systems) e, em seguida, incubadas com anticorpo IgG suíno anti-cabra marcado com FITC (Caltag Laboratories) . As células marcadas foram analisadas por citometria de fluxo com um citômetro de fluxo FACSCalibur (BD Biosciences). Para estudos de biossíntese de ACE2, células Vero E6 foram pulsadas com 250 μCi 35 S- (Met) (Perkin Elmer) por 3 h com as concentrações indicadas de cloroquina ou NH 4Cl e então lisado em tampão RIPA. Os lisados clarificados foram imunoprecipitados com um anticorpo anti-ACE2 de cabra purificado por afinidade (sistemas R&D), e as proteínas imunoprecipitadas foram separadas por eletroforese em gel de SDS-poliacrilamida.
Referências
1
Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S, Tong S, Urbani C, Comer JA, Lim W, Rollin PE, Dowell SF, Ling AE, Humphrey CD, Shieh WJ, Guarner J, Paddock CD , Rota PB, Campos B, DeRisi J, Yang JY, Cox N, Hughes J, LeDuc JW, Bellini WJ, Anderson LJ, Grupo de Trabalho SARS: Um novo coronavírus associado à síndrome respiratória aguda grave. N Engl J Med 2003, 348: 1953-1966. 10.1056 / NEJMoa030781
CAS Artigo PubMed Google Scholar
2
Marra MA, Jones SJ, Astell CR, Holt RA, Brooks-Wilson A, Butterfield YS, Khattra J, Asano JK, Barber SA, Chan SY, Cloutier A, Coughlin SM, Freeman D, Girn N, Griffith OL, Leach SR, Mayo, McDonald H, Montgomery SB, Pandoh PK, Petrescu AS, Robertson AG, Schein JE, Siddiqui A, Smailus DE, Stott JM, Yang GS, Plummer F, Andonov A, Artsob H, Bastien N, Bernard K, Booth TF, Bowness D, Czub M, Drebot M, Fernando L, Flick R, Garbutt M, Gray M, Grolla A, Jones S, Feldmann H, Meyers A, Kabani A, Li Y, Normand S, Stroher U, Tipples GA, Tyler S , Vogrig R, Ward D, Watson B, Brunham RC, Krajden M, Petric M, Skowronski DM, Upton C, Roper RL: A sequência do genoma do coronavírus associado a SARS. Science 2003, 300: 1399-1404. 10.1126 / science.1085953
CAS Artigo PubMed Google Scholar
3 -
Rota PA, Oberste MS, Monroe SS, Nix WA, Campagnoli R, Icenogle JP, Penaranda S, Bankamp B, Maher K, Chen MH, Tong S, Tamin A, Lowe L, Frace M, DeRisi JL, Chen Q, Wang D , Erdman DD, Peret TC, Burns C, Ksiazek TG, Rollin PE, Sanchez A, Liffick S, Holloway B, Limor J, McCaustland K, Olsen Rasmussen M, Fouchier R, Gunther S, Osterhaus AS, Drosten C, Pallansch MA, Anderson LJ, Bellini WJ: Caracterização de um novo coronavírus associado à síndrome respiratória aguda grave. Science 2003, 300: 1394-1399. 10.1126 / science.1085952
CAS Artigo PubMed Google Scholar
4 -
Ng ML, Tan SH, Ver EE, Ooi EE, Ling AE: Proliferative growth of SARS coronavirus in Vero E6 cells. J Gen Virol 2003, 84: 3291-3303. 10.1099 / vir.0.19505-0
CAS Artigo PubMed Google Scholar
5
Li M, Moore WJ, Vasilieva N, Sui J, Wong SK, Berne MA, Somasundaran M, Sullivan JL, Luzuriaga K, Greenough TC, Choe H, Farzan M: A enzima de conversão de angiotensina 2 é um receptor funcional para o coronavírus SARS. Nature 2003, 426: 450-454. 10.1038 / nature02145
CAS Artigo PubMed Google Scholar
6
Bergeron E, Vincent MJ, Wickham L, Hamelin J, Basak A, Nichol ST, Chrétien M, NG Seidah: Implicação de convertases de pró-proteína no processamento e disseminação de coronavírus da síndrome respiratória aguda grave. Biochem Biophys Res Comm 2005, 326: 554-563. 10.1016 / j.bbrc.2004.11.063
CAS Artigo PubMed Google Scholar
7
Zhang Y, Li T, Fu L, Yu C, Li Y, Xu X, Wang Y, Ning H, Zhang S, Chen W, Babiuk LA, Chang Z: Silenciando a expressão da proteína spike SARS-CoV em células cultivadas por interferência de RNA. FEBS Lett 2004, 560: 141-146. 10.1016 / S0014-5793 (04) 00087-0
CAS Artigo PubMed Google Scholar
8
Subbarao K, McAuliffe J, Vogel L, Fahle G, Fischer S, Tatti K, Packard M, Shieh WJ, Zaki S, Murphy B: A infecção prévia e a transferência passiva de anticorpo neutralizante impedem a replicação do coronavírus da síndrome respiratória aguda grave no trato respiratório de ratos. J Virol 2004, 78: 3572-3577. 10.1128 / JVI.78.7.3572-3577.2004
PubMed Central CAS Artigo PubMed Google Scholar
9
Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K, Nabel GJ: Uma vacina de DNA induz a neutralização do coronavírus SARS e imunidade protetora em camundongos. Nature 2004, 428: 561-564. 10.1038 / nature02463
CAS Artigo PubMed Google Scholar
10
Bisht H, Roberts A, Vogel L, Bukreyev A, Collins PL, Murphy BR, Subbarao K, Moss B: A proteína de pico de coronavírus da síndrome respiratória aguda grave expressa pelo vírus vaccinia atenuado imuniza de forma protetora os ratos. Proc Natl Acad Sci USA 2004, 101: 6641-6646. 10.1073 / pnas.0401939101
PubMed Central CAS Artigo PubMed Google Scholar
11
Bukreyev A, Lamirande EW, Buchholz UJ, Vogel LN, Elkins WR, St. Claire M, Murphy BR, Subbarao K, Collins PL: Imunização mucosa de macacos verdes africanos (Cercopithecus aethiops) com um vírus de parainfluenza atenuado que expressa o pico de proteína do coronavírus SARS para a prevenção da SARS. Lancet 2004, 363: 2122-2127. 10.1016 / S0140-6736 (04) 16501-X
CAS Artigo PubMed Google Scholar
12
Sainz B Jr, Mossel EC, Peters CJ, Garry RF: Interferon-beta e interferon-gama inibem sinergicamente a replicação do coronavírus associado à síndrome respiratória aguda grave (SARS-CoV). Virology 2004, 329: 11-17. 10.1016 / j.virol.2004.08.011
CAS Artigo PubMed Google Scholar
13
Stroher U, DiCaro A, Li Y, Strong JE, Aoki F, Plummer F, Jones SM, Feldmann H: O coronavírus relacionado à síndrome respiratória aguda grave é inibido pelo interferon-alfa. J Infect Dis 2004, 189: 1164-1167. 10.1086 / 382597
Artigo PubMed Google Scholar
14
Sui J, Li W, Murakami A, Tamin A, Matthews LJ, Wong SK, Moore MJ, Tallarico AS, Olurinde M, Choe H, Anderson LJ, Bellini WJ, Farzan M, Marasco WA: Neutralização potente da síndrome respiratória aguda grave ( SARS) coronavírus por um mAb humano à proteína S1 que bloqueia a associação do receptor. Proc Natl Acad Sci USA 2004, 101: 2536-2541. 10.1073 / pnas.0307140101
PubMed Central CAS Artigo PubMed Google Scholar
15
Savarino A, Boelaert JR, Cassone A, Majori G, Cauda R: Efeitos da cloroquina nas infecções virais: um medicamento antigo contra as doenças de hoje? Lancet Infect Dis 2003, 3: 722-727. 10.1016 / S1473-3099 (03) 00806-5
CAS Artigo PubMed Google Scholar
16
Ng ML, Tan SH, Veja EE, Ooi EE, Ling AE: Primeiros eventos de infecção por coronavírus SARS em células vero. J Med Virol 2003, 71: 323-331. 10.1002 / jmv.10499
CAS Artigo PubMed Google Scholar
17
Simmons G, Reeves JD, Rennekamp AJ, Amberg SM, Piefer AJ, Bates P: Caracterização de entrada viral mediada por glicoproteína de pico de coronavírus associado à síndrome respiratória aguda grave (SARS-CoV). Proc Natl Acad Sci USA 2004, 101: 4240-4245. 10.1073 / pnas.0306446101
PubMed Central CAS Artigo PubMed Google Scholar
18
Yang ZY, Huang Y, Ganesh L, Leung K, Kong WP, Schwartz O, Subbarao K, Nabel GJ: a entrada dependente do pH do coronavírus da síndrome respiratória aguda grave é mediada pela glicoproteína de pico e aumentada pela transferência de células dendríticas através de DC-SIGN . J Virol 2004, 78: 5642-5650. 10.1128 / JVI.78.11.5642-5650.2004
PubMed Central CAS Artigo PubMed Google Scholar
19
Tipnis SR, Hooper NM, Hyde R, Karran E, Christie G, Turner AJ: Um homólogo humano da enzima conversora de angiotensina. Clonagem e expressão funcional como uma carboxipeptidase insensível a captopril. J Biol Chem 2000, 275: 33238-33243. 10.1074 / jbc.M002615200
CAS Artigo PubMed Google Scholar
20
Song HC, Seo MY, Stadler K, Yoo BJ, Choo QL, Coates SR, Uematsu Y, Harada T, Greer CE, Polo JM, Pileri P, Eickmann M, Rappuoli R, Abrignani S, Houghton M, Han JH: Síntese e caracterização de uma forma oligomérica nativa de glicoproteína de pico de coronavírus da síndrome respiratória aguda grave recombinante. J Virol 2004, 78: 10328-10335. 10.1128 / JVI.78.19.10328-10335.2004
PubMed Central CAS Artigo PubMed Google Scholar
21
Keyaerts E, Vijgen L, Maes P, Neyts J, Ranst MV: In vitro inibição de coronavírus de síndrome respiratória aguda grave por cloroquina. Biochem Biophys Res Commun 2004, 323: 264-268. 10.1016 / j.bbrc.2004.08.085
CAS Artigo PubMed Google Scholar
22
Thorens B, Vassalli P: Cloroquina e cloreto de amônio previnem a glicosilação terminal de imunoglobulinas em células plasmáticas sem afetar a secreção. Nature 1986, 321: 618-620. 10.1038 / 321618a0
CAS Artigo PubMed Google Scholar
23
Dille BJ, Johnson TC: Inibição da expressão da glicoproteína do vírus da estomatite vesicular pela cloroquina. J Gen Virol 1982, 62: 91-103.
CAS Artigo PubMed Google Scholar
24
Tsai WP, Nara PL, Kung HF, Oroszlan S: Inibição de infectividade do vírus da imunodeficiência humana por cloroquina. AIDS Res Hum Retroviruses 1990, 6: 481-489.
CAS Artigo PubMed Google Scholar
25
Savarino A, Lucia MB, Rastrelli E, Rutella S, Golotta C, Morra E, Tamburrini E, Perno CF, Boelaert JR, Sperber K, Cauda RC: Efeitos anti-HIV da cloroquina: inibição da glicosilação de partículas virais e sinergismo com inibidores da protease . J Acquir Immune Defic Syndr 2004, 35: 223-232.
CAS Artigo PubMed Google Scholar
26
Ducharme J, Farinotti R: Clinical pharmacokinetics and metabolism of cloroquine. Concentre-se nos avanços recentes. Clin Pharmacokinet 1996, 31: 257-274.
CAS Artigo PubMed Google Scholar
Baixar referências
Reconhecimentos
Agradecemos a Claudia Chesley e Jonathan Towner pela leitura crítica do manuscrito. Este trabalho foi apoiado por uma concessão canadense PENCE (T3), concessão do grupo CIHR #MGC 64518 e concessão CIHR # MGP-44363 (para NGS).
Informação sobre o autor
Afiliações
Special Pathogens Brach, Divisão de Doenças Virais e Rickettsiais, Centros para Controle e Prevenção de Doenças, Atlanta, Geórgia, 1600 Clifton Road, 30333, EUA
Martin J Vincent, Bobbie R Erickson, Pierre E Rollin, Thomas G Ksiazek e Stuart T Nichol
Laboratório de Neuroendocrinologia Bioquímica, Instituto de Pesquisa Clínica de Montreal, Montreal, 110 Pine Ave West, QCH2W1R7, Canadá
Eric Bergeron, Suzanne Benjannet e Nabil G Seidah
autor correspondente
Correspondência para Stuart T Nichol .
Informação adicional
Interesses competitivos
O (s) autor (es) declaram não ter interesses conflitantes.
Contribuições dos autores
MV fez todos os experimentos relativos à infecção por SARS CoV e coordenou a redação do manuscrito. EB e SB realizaram experimentos na biossíntese de ACE2 e análise FACS. BE realizou a aquisição de dados dos experimentos de imunofluorescência. PR e TK forneceram reagentes essenciais e revisaram o manuscrito criticamente. NS e SN juntamente com MV e EB participaram do planejamento dos experimentos, revisão e interpretação dos dados e revisão crítica do manuscrito. Todos os autores leram e aprovaram o conteúdo do manuscrito.
Arquivos originais enviados pelos autores para imagens
Abaixo estão os links para os arquivos originais enviados pelos autores para imagens.
Arquivo original dos autores para a figura 1
Arquivo original dos autores para a figura 2
Arquivo original dos autores para a figura 3
Arquivo original dos autores para a figura 4
Arquivo original dos autores para a figura 5
Arquivo original dos autores para a figura 6
Direitos e permissões
Reimpressões e permissões
Sobre este artigo
Cite este artigo
Vincent, MJ, Bergeron, E., Benjannet, S. et al. A cloroquina é um inibidor potente da infecção e disseminação do coronavírus SARS. Virol J 2, 69 (2005). https://doi.org/10.1186/1743-422X-2-69
Baixar citação
Recebido12 de julho de 2005
Aceitaram22 de agosto de 2005
Publicados22 de agosto de 2005
DOIhttps://doi.org/10.1186/1743-422X-2-69
Resumo
fundo
A síndrome respiratória aguda grave (SARS) é causada por um coronavírus recém-descoberto (SARS-CoV). Nenhuma terapia profilática ou pós-exposição eficaz está disponível atualmente.
Resultados
No entanto, relatamos que a cloroquina tem fortes efeitos antivirais na infecção por SARS-CoV de células de primatas. Esses efeitos inibitórios são observados quando as células são tratadas com a droga antes ou depois da exposição ao vírus, sugerindo vantagem profilática e terapêutica. Além das funções bem conhecidas da cloroquina, como elevações do pH endossomal, a droga parece interferir na glicosilação terminal do receptor celular, a enzima conversora de angiotensina 2. Isso pode influenciar negativamente a ligação do vírus-receptor e anular a infecção, com outras ramificações pela elevação do pH vesicular, resultando na inibição da infecção e disseminação do SARS CoV em concentrações clinicamente admissíveis.
Conclusão
A cloroquina é eficaz na prevenção da propagação do SARS CoV em cultura de células. A inibição favorável da propagação do vírus foi observada quando as células foram tratadas com cloroquina antes ou após a infecção por SARS CoV. Além disso, o ensaio de imunofluorescência indireta aqui descrito representa um método simples e rápido para a triagem de compostos antivirais SARS-CoV.
fundo
A síndrome respiratória aguda grave (SARS) é uma doença emergente que foi relatada pela primeira vez na província de Guangdong, China, no final de 2002. A doença se espalhou rapidamente para pelo menos 30 países poucos meses após seu primeiro aparecimento, e esforços mundiais combinados levaram à identificação de o agente etiológico como coronavírus SARS (SARS-CoV), um novo membro da família Coronaviridae [ 1 ]. O sequenciamento completo do genoma do SARS-CoV [ 2 , 3 ] confirmou que esse patógeno não está intimamente relacionado a nenhum dos grupos de coronavírus previamente estabelecidos. O brotamento do SARS-CoV ocorre no aparelho de Golgi [ 4] e resulta na incorporação da glicoproteína do pico do envelope no vírion. A glicoproteína de pico é uma proteína de membrana do tipo I que facilita a ligação viral ao receptor celular e o início da infecção, e a enzima conversora de angiotensina-2 (ACE2) foi identificada como um receptor celular funcional de SARS-CoV [ 5 ]. Recentemente, mostramos que o processamento da proteína spike foi efetuado por converttases semelhantes à furina e que a inibição dessa clivagem por um inibidor específico anulou a citopatia e reduziu significativamente o título do vírus de SARS-CoV [ 6 ].
Devido à gravidade da infecção por SARS-CoV, o potencial de disseminação rápida da doença e a ausência de inibidores in vivo comprovadamente eficazes e seguros do vírus, é importante identificar medicamentos que podem ser usados com eficácia para tratar ou prevenir potenciais Infecções por SARS-CoV. Muitas novas abordagens terapêuticas foram avaliadas em estudos de laboratório de SARS-CoV: notáveis entre essas abordagens são aquelas que usam siRNA [ 7 ], transferência passiva de anticorpos [ 8 ], vacinação de DNA [ 9 ], vaccinia ou vírus parainfluenza expressando a proteína spike [ 10] , 11 ], interferões [ 12 , 13], e anticorpo monoclonal para a subunidade S1 da glicoproteína de pico que bloqueia a ligação ao receptor [ 14] Neste relatório, descrevemos a identificação da cloroquina como um agente antiviral pré e pós-infecção eficaz para SARS-CoV. A cloroquina, uma 9-aminoquinolina identificada em 1934, é uma base fraca que aumenta o pH das vesículas ácidas. Quando adicionada extracelularmente, a porção não protonada da cloroquina entra na célula, onde se torna protonada e concentrada em organelas ácidas de baixo pH, como endossomos, vesículas de Golgi e lisossomas. A cloroquina pode afetar a infecção pelo vírus de várias maneiras, e o efeito antiviral depende em parte da extensão em que o vírus utiliza os endossomos para a entrada. A cloroquina tem sido amplamente utilizada para tratar doenças humanas, como malária, amebiose, HIV e doenças autoimunes, sem efeitos colaterais prejudiciais significativos [ 15] Junto com os dados apresentados aqui, mostrando a inibição do vírus em cultura de células por doses de cloroquina compatíveis com o tratamento do paciente, essas características sugerem que uma avaliação mais aprofundada da cloroquina em modelos animais de infecção por SARS-CoV seria garantida à medida que progredimos para encontrar antivirais eficazes para prevenção ou tratamento da doença.
Resultados
O tratamento pré-infecção com cloroquina torna as células Vero E6 refratárias à infecção por SARS-CoV
A fim de investigar se a cloroquina pode prevenir a infecção por SARS-CoV, células Vero E6 permissivas [ 1 ] foram pré-tratadas com várias concentrações de cloroquina (0,1–10 μM) por 20–24 h antes da infecção do vírus. As células foram então infectadas com SARS-CoV e os antígenos do vírus foram visualizados por imunofluorescência indireta, conforme descrito em Materiais e Métodos. Exame microscópico (Fig. 1A) das células de controle (não tratadas, infectadas) revelaram extensa imunomarcação específica para SARS-CoV da monocamada. Uma diminuição dependente da dose nas células positivas para o antígeno do vírus foi observada a partir de 0,1 μM de cloroquina, e concentrações de 10 μM aboliram completamente a infecção por SARS-CoV. Para fins quantitativos, contamos o número de células com coloração positiva em três locais aleatórios em uma lâmina. O número médio de células de controle coradas positivamente foi classificado como 100% e foi comparado com o número de células positivas observadas em várias concentrações de cloroquina (Fig. 1B) O pré-tratamento com 0,1, 1 e 10 μM de cloroquina reduziu a infectividade em 28%, 53% e 100%, respectivamente. Resultados reproduzíveis foram obtidos a partir de três experiências independentes. Esses dados demonstraram que o pré-tratamento de células Vero E6 com cloroquina tornou essas células refratárias à infecção por SARS-CoV.
figura 1

Efeito profilático da cloroquina . Células Vero E6 pré-tratadas com cloroquina por 20 horas. Os meios contendo cloroquina foram removidos e as células foram lavadas com solução salina tamponada com fosfato antes de serem infectadas com SARS-CoV (0,5 multiplicidade de infecção) por 1 h. na ausência de cloroquina. O vírus foi então removido e as células foram mantidas em Opti-MEM (Invitrogen) por 16–18 h na ausência de cloroquina. Os antígenos SARS-CoV foram corados com HMAF específico para vírus, seguido por anticorpos secundários conjugados com FITC. (A) A concentração de cloroquina usada é indicada no topo de cada painel. (B)Células positivas para o antígeno SARS-CoV em três locais aleatórios foram capturadas usando uma câmera digital, o número de células positivas para o antígeno foi determinado e a inibição média foi calculada. A inibição percentual foi obtida considerando o controle não tratado como 0% de inibição. As barras verticais representam o intervalo de SEM.
Imagem em tamanho real
O tratamento com cloroquina pós-infecção é eficaz na prevenção da disseminação da infecção por SARS-CoV
A fim de investigar as propriedades antivirais da cloroquina no SARS-CoV após o início da infecção, células Vero E6 foram infectadas com o vírus e meio fresco suplementado com várias concentrações de cloroquina foi adicionado imediatamente após a adsorção do vírus. As células infectadas foram incubadas por mais 16–18 h, após as quais a presença de antígenos virais foi analisada por análise de imunofluorescência indireta. Quando a cloroquina foi adicionada após o início da infecção, houve uma diminuição dramática dependente da dose no número de células positivas para o antígeno do vírus (Fig. 2A ). Tão pouco quanto 0,1-1 μM de cloroquina reduziu a infecção em 50% e até 90-94% de inibição foi observada com concentrações de 33-100 μM (Fig. 2B) Em concentrações de cloroquina superiores a 1 μM, apenas um pequeno número de células individuais foi inicialmente infectado e a disseminação da infecção para as células adjacentes foi praticamente eliminada. A metade do efeito inibitório máximo foi estimada para ocorrer em 4,4 ± 1,0 μM de cloroquina (Fig. 2C ). Esses dados mostram claramente que a adição de cloroquina pode reduzir efetivamente o estabelecimento da infecção e a disseminação do SARS-CoV se a droga for adicionada imediatamente após a adsorção do vírus.
Figura 2

O tratamento com cloroquina pós-infecção reduz a infecção e disseminação da SARS-CoV . As células Vero E6 foram semeadas e infectadas como descrito para a Fig. 1, exceto que a cloroquina foi adicionada apenas após a adsorção do vírus. As células foram mantidas em Opti-MEM (Invitrogen) contendo cloroquina por 16–18 h, após as quais foram processadas para imunofluorescência. (A) A concentração de cloroquina é indicada na parte superior. (B) A inibição percentual e SEM foram calculados como na Fig. 1B. (C) A dose eficaz (ED 50 ) foi calculada utilizando o software comercialmente disponível (Grafit, versão 4, Erithacus Software).
Imagem em tamanho real
A análise de microscopia eletrônica indicou o aparecimento de quantidades significativas de partículas virais extracelulares 5–6 h após a infecção [ 16 ]. Uma vez que observamos os efeitos antivirais da cloroquina imediatamente após a adsorção do vírus, estendemos ainda mais a análise adicionando cloroquina 3 e 5 h após a adsorção do vírus e examinamos a presença de antígenos do vírus após 20 h. Descobrimos que a cloroquina ainda era significativamente eficaz, mesmo quando adicionada 5 horas após a infecção (Fig. 3 ); entretanto, para obter efeito antiviral equivalente, uma concentração maior de cloroquina era necessária se a droga fosse adicionada 3 ou 5 horas após a adsorção.
Figura 3

Tratamento pós-infecção cronometrado com cloroquina . Este experimento é semelhante ao representado na Fig. 2, exceto que as células foram infectadas em 1 multiplicidade de infecção e cloroquina (10, 25 e 50 μM) foi adicionada 3 ou 5 h após a infecção.
Imagem em tamanho real
Cloreto de amônio inibe a infecção por SARS-CoV de células Vero E6
Uma vez que a cloroquina inibiu a infecção por SARS-CoV quando adicionada antes ou após a infecção, formulamos a hipótese de que outro agente lisosomotrópico comum, o NH 4 Cl, também pode funcionar de maneira semelhante. O cloreto de amônio tem sido amplamente utilizado em estudos que abordam a entrada de vírus mediada por endossomo. Coincidentemente, o NH 4 Cl foi recentemente mostrado para reduzir a transdução de vírus de pseudótipo decorados com a proteína spike SARS-CoV [ 17 , 18 ]. Em uma tentativa de examinar se NH 4 Cl funciona de forma semelhante à cloroquina, realizamos análises de infecção em células Vero E6 antes (Fig. 4A ) e depois (Fig. 4B ) de serem tratadas com várias concentrações de NH 4Cl. Em ambos os casos, observamos uma inibição de 93-99% com NH 4 Cl a ≥ 5 mM. Estes dados indicaram que o NH 4 Cl (≥ 5 mM) e a cloroquina (≥ 10 μM) são muito eficazes na redução da infecção por SARS-CoV. Esses resultados sugerem que os efeitos da cloroquina e do NH 4 Cl no controle da infecção e disseminação do SARS CoV podem ser mediados por mecanismo (s) semelhante (s).
Figura 4

O NH 4 Cl inibe a SARS-CoV durante o tratamento pré ou pós-infecção . NH 4 Cl foi adicionado às células antes (A) ou após (B) a infecção, semelhante ao que foi feito para a cloroquina nas Figs. 1 e 2. As células positivas para o antígeno foram contadas e os resultados foram apresentados como na Fig. 1B .
Imagem em tamanho real
Efeito da cloroquina e NH 4 Cl na expressão da superfície celular de ACE2
Realizamos experimentos adicionais para elucidar o mecanismo de inibição da SARS-CoV pela cloroquina e pelo NH 4 Cl. Uma vez que o pH ácido intra-vesicular regula as funções celulares, incluindo corte de N-glicosilação, tráfego celular e várias atividades enzimáticas, era de interesse caracterizar o efeito de ambas as drogas no processamento, glicosilação e classificação celular da glicoproteína de pico SARS-CoV e seu receptor, ACE2. A análise de citometria de fluxo foi realizada em células Vero E6 que não foram tratadas ou foram tratadas com concentrações anti-SARS-CoV altamente eficazes de cloroquina ou NH 4Cl. Os resultados revelaram que nenhuma das drogas causou uma mudança significativa nos níveis de ACE2 da superfície celular, indicando que os efeitos inibitórios observados na infecção por SARS-CoV não são devidos à falta de ACE2 disponível na superfície celular (Fig. 5A ). Em seguida, analisamos as formas moleculares de ACE2 endógeno em células Vero E6 não tratadas e em células que foram pré-incubadas por 1 h com várias concentrações de NH 4 Cl (2,5–10 mM) ou cloroquina (1 e 10 μM) e marcadas com 35 S- (Met) por 3 h na presença ou ausência dos medicamentos (Fig. 5B e 5C ). Em condições normais, observamos duas formas de ACE2 imunorreativas, migrando a ~ 105 e ~ 113 kDa, respectivamente (Fig. 5B, pista 1). A proteína de ~ 105 kDa é sensível à endoglicosidase H, sugerindo que ela representa a forma localizada do retículo endoplasmático (ER), enquanto a proteína de ~ 113 kDa é resistente à endoglicosidase H e representa a forma modificada por Golgi de ACE2 [ 19 ]. A especificidade do anticorpo foi confirmada pelo deslocamento das bandas de proteína imunorreativa com excesso de ACE2 humano recombinante solúvel em frio (+ rhACE2; Fig. 5B , faixa 2). Quando analisamos as formas de ACE2 na presença de NH 4 Cl, um claro aumento gradual na migração da proteína ~ 113-kDa foi observado com concentrações crescentes de NH 4 Cl, com um efeito máximo observado em NH 4 Cl 10 mM , resultando em apenas a forma ER de ACE2 sendo visível no gel (Fig.5B , compare as pistas 3-5). Isto sugeriu que o corte e / ou modificações terminais das cadeias N-glicosiladas de ACE2 foram afetadas pelo tratamento com NH 4 Cl. Além disso, em NH 4 Cl 10 mM , a forma ER de ACE2 migrou com mobilidade ligeiramente mais rápida, indicando que NH 4 Cl nessa concentração também pode afetar a glicosilação do núcleo. Também examinamos o estado de glicosilação terminal de ACE2 quando as células foram tratadas com cloroquina (Fig. 5C ). Semelhante ao NH 4Cl, um aumento gradual na mobilidade eletroforética de ACE2 foi observado com concentrações crescentes de cloroquina. A 25 μM de cloroquina, a mobilidade eletroforética mais rápida da forma modificada por Golgi de ACE2 foi claramente evidente. Com base na citometria de fluxo e nas análises de imunoprecipitação, pode-se inferir que o NH 4 Cl e a cloroquina prejudicaram a glicosilação terminal de ACE2, enquanto o NH 4 Cl resultou em um efeito mais dramático. Embora ACE2 seja expresso em quantidades semelhantes na superfície celular, as variações em seu estado de glicosilação podem tornar a interação ACE2-SARS-CoV menos eficiente e inibir a entrada do vírus quando as células são tratadas com NH 4 Cl e cloroquina.
Figura 5

Efeito de agentes lisomotrópicos na expressão da superfície celular e na biossíntese de ACE2 . (A) As células Vero E6 foram cultivadas por 20 h na ausência (controle) ou na presença de cloroquina (10 μM) ou NH 4 Cl (20 mM). As células foram marcadas com anti-ACE2 (histograma cinza) ou com um anticorpo secundário sozinho (histograma branco). (B) Biossíntese de ACE2 em células não tratadas ou em células tratadas com NH 4 Cl. As células Vero E6 foram marcadas com pulso por 3 h com 35S-Met e os lisados celulares foram imunoprecipitados com um anticorpo ACE2 (faixa 1). A pré-incubação do anticorpo com ACE2 humano recombinante (rhACE2) aboliu completamente o sinal (faixa 2). As posições da forma ER sensível à endoglicosidase H e da forma Golgi resistente à endoglicosidase H de ACE2 são enfatizadas. Observe que o aumento da concentração de NH 4 Cl resulta na diminuição da forma Golgi de ACE2. (C) Um experimento semelhante foi realizado na presença das concentrações indicadas de cloroquina. Observe a perda de glicanos terminais com concentrações crescentes de cloroquina. (D)A modificação glicosídica terminal de ACE2 foi avaliada por tratamento com neuraminidase de ACE2 imunoprecipitado. Aqui, as células foram tratadas com concentrações de 1–25 μM de cloroquina durante a fome, pulso e perseguição de 3 horas.
Imagem em tamanho real
Para confirmar que ACE2 sofre modificações terminais de açúcar e que a glicosilação terminal é afetada por NH 4 Cl ou tratamento com cloroquina, realizamos imunopreipitação de ACE2 marcado com 35 S e submetemos os imunoprecipitados à digestão por neuraminidase. As proteínas foram resolvidas usando SDS-PAGE (Fig 5D ). É evidente a partir da mobilidade ligeiramente mais rápida da forma Golgi de ACE2 após o tratamento com neuraminidase (Fig 5D , compare as pistas 1 e 2), que ACE2 sofre glicosilação terminal; no entanto, a forma ER de ACE2 não foi afetada pela neuraminidase. As células tratadas com 10 μM de cloroquina não resultaram em uma mudança significativa; enquanto que 25 μM de cloroquina fez com que a forma Golgi de ACE2 se resolvesse de maneira semelhante à ACE2 tratada com neuraminidase (Fig.5D , compare as pistas 5 e 6). Esses dados fornecem evidências de que ACE2 sofre glicosilação terminal e que a cloroquina em concentrações de anti-SARS-CoV anula o processo.
Efeito da cloroquina e NH 4 Cl na biossíntese e processamento da proteína spike SARS-CoV
Em seguida, abordamos se as drogas lisossomotrópicas (NH 4 Cl e cloroquina) afetam a biossíntese, glicosilação e / ou tráfego da glicoproteína de pico SARS-CoV. Para tanto, células Vero E6 foram infectadas com SARS-CoV por 18 h. Cloroquina ou cloreto de amônio foi adicionado a essas células durante o período de privação (1 h), marcado (30 min) ou perseguido (3 h). Os lisados celulares foram analisados por imunoprecipitação com o anticorpo policlonal específico para SARS (HMAF). Os resultados de pulso de 30 min indicaram que o pró-pico (proS) foi sintetizado como um precursor de ~ 190 kDa (proS-ER) e processado em proteínas ~ 125, ~ 105 e ~ 80 kDa (Fig. 6A , pista 2), um resultado idêntico ao de nossa análise anterior [ 6 ]. Exceto para a cloroquina 100 μM (Fig.6A , faixa 3), não houve diferença significativa na biossíntese ou processamento da proteína spike do vírus em células não tratadas ou tratadas com cloroquina (Fig. 6A , faixas 4-6). Deve-se notar que a cloroquina a 100 μM resultou em uma diminuição geral na biossíntese e nos níveis de glicoproteína viral processada. Em vista da falta de redução na biossíntese e processamento da glicoproteína de pico na presença de concentrações de cloroquina (10 e 50 μM) que causaram grandes reduções na replicação e disseminação do SARS-CoV, concluímos que o efeito antiviral provavelmente não é devido à alteração da biossíntese e processamento da glicoproteína viral. Análises semelhantes foram realizadas com NH 4Cl, e os dados sugeriram que a biossíntese e o processamento da proteína spike também não foram afetados negativamente pelo NH 4 Cl (Fig. 6A , pistas 7-12). Consistente com nossa análise anterior [ 6 ], observamos a presença de uma proteína maior, que é referida aqui como oligômeros. Recentemente, Song et al. [ 20 ] forneceram evidências de que estes são homotrímeros da proteína spike SARS-CoV e foram incorporados aos vírions. Curiosamente, os níveis dos homotrímeros nas células tratadas com 100 μM de cloroquina e 40 e 20 mM de NH 4 Cl (Fig. 6A , pistas 3, 9 e 10) foram ligeiramente mais baixos do que nas células de controle ou células tratadas com concentrações de drogas mais baixas.
Figura 6

Efeitos do NH 4 Cl e da cloroquina (CQ) na biossíntese, processamento e glicosilação da proteína spike SARS-CoV . As células Vero E6 foram infectadas com SARS-CoV conforme descrito na Fig. 2. CQ ou NH 4 Cl foi adicionado durante os períodos de privação (1 h) e marcação (30 min) com 35 S-Cys e seguido de perseguição por 3 h na presença de meio não marcado. As células foram lisadas em tampão RIPA e imunoprecipitadas com HMAF. As proteínas do vírus foram resolvidas usando gel NuPAGE 3–8% (Invitrogen). As células apresentadas foram marcadas por 30 min (A) e perseguidas por 3 h (B) . As posições de migração das várias formas moleculares de pico são indicadas no lado direito, e as dos padrões moleculares são mostradas no lado esquerdo. proS-ER e proS-Golgi são os pró-pico de SARS-Co nos compartimentos ER e Golgi, respectivamente, e proS-ungly é o pró-pico ER não glicosilado.
Imagem em tamanho real
Os dados obtidos a partir de um pulso de 30 min seguido por uma perseguição de 3 h (Fig. 6B , pistas 2 e 8) confirmaram nossa observação anterior de que o precursor da proteína spike SARS-CoV (proS-ER) adquire modificações específicas de Golgi (proS -Golgi) resultando em uma proteína de ~ 210 kDa [ 6 ]. A cloroquina a 10, 25 e 50 μM não teve impacto negativo substancial sobre o aparecimento da forma de Golgi (Fig. 6B , compare a pista 2 com as pistas 4-6). Apenas a 100 μM de cloroquina foi observada uma redução no nível do pró-pico modificado por Golgi (faixa 3). Por outro lado, NH 4Cl anulou o aparecimento de formas modificadas por Golgi a ≥10 mM (compare a faixa 8 com 9-11) e teve um efeito mais suave a 1 mM (faixa 12). Esses dados demonstram claramente que a biossíntese e o processamento proteolítico da proteína spike SARS-CoV não são afetados nas doses de cloroquina (25 e 50 μM) e NH 4 Cl (1 mM) que causam efeitos inibidores do vírus. Além disso, com 40, 20 e 10 mM de NH 4 Cl, houve um aumento do acúmulo de proS-ER com uma diminuição concomitante na quantidade de oligômeros (Fig. 6B , pistas 9-11). Quando examinamos os homotrímeros, descobrimos que a cloroquina a 100 μM e o NH 4 Cl a 40 e 20 mM resultou em uma mobilidade ligeiramente mais rápida dos trímeros (Fig. 6B, pistas 3, 9 e 10), mas as doses mais baixas do medicamento, que exibiram efeitos antivirais significativos, não resultaram em diferenças apreciáveis. Esses dados sugerem que a proteína de pico intracelular recém-sintetizada pode não ser um alvo principal para a cloroquina e a ação antiviral do NH 4 Cl. A mobilidade mais rápida do trímero em certas concentrações mais altas dos fármacos pode ser devido ao efeito desses fármacos na glicosilação terminal dos trímeros.
Discussão
Identificamos a cloroquina como um agente antiviral eficaz para SARS-CoV em condições de cultura de células, conforme evidenciado por seu efeito inibitório quando a droga foi adicionada antes da infecção ou após o início e o estabelecimento da infecção. O fato de a cloroquina exercer um efeito antiviral durante as condições pré e pós-infecção sugere que é provável que tenha vantagens profiláticas e terapêuticas. Recentemente, Keyaerts et al. [ 21 ] relataram as propriedades antivirais da cloroquina e identificaram que a droga afeta a replicação do SARS-CoV em cultura de células, conforme evidenciado por RT-PCR quantitativo. Tomados em conjunto com os achados de Keyaerts et al. [ 21], nossa análise fornece evidências adicionais de que a cloroquina é eficaz contra as cepas SARS-CoV Frankfurt e Urbani. Fornecemos evidências de que a cloroquina é eficaz na prevenção da infecção por SARS-CoV em cultura de células se a droga for adicionada às células 24 horas antes da infecção. Além disso, a cloroquina foi significativamente eficaz mesmo quando a droga foi adicionada 3–5 h após a infecção, sugerindo um efeito antiviral mesmo após o estabelecimento da infecção. Uma vez que resultados semelhantes foram obtidos pelo tratamento com NH 4 Cl de células Vero E6, o (s) mecanismo (s) de ação subjacente (s) dessas drogas podem ser semelhantes.
Além do provável papel da cloroquina na replicação do SARS-CoV, os mecanismos de ação da cloroquina no SARS-CoV não são totalmente compreendidos. Estudos anteriores sugeriram a elevação do pH como um mecanismo pelo qual a cloroquina reduz a transdução de vírus do pseudótipo SARS-CoV [ 17 , 18 ]. Examinamos o efeito da cloroquina e NH 4 Cl nas proteínas de pico SARS-CoV e em seu receptor, ACE2. Os resultados de imunoprecipitação de ACE2 demonstraram claramente que as concentrações anti-SARS-CoV eficazes de cloroquina e NH 4Cl também prejudicou a glicosilação terminal de ACE2. No entanto, os dados de citometria de fluxo demonstraram que não há diferenças significativas na expressão da superfície celular de ACE2 em células tratadas com cloroquina ou NH 4 Cl. Com base nesses resultados, é razoável sugerir que o pré-tratamento com NH 4O Cl ou a cloroquina possivelmente resultou na expressão superficial do ACE2 subglicosilado. No caso do tratamento com cloroquina antes da infecção, o comprometimento da glicosilação terminal de ACE2 pode resultar em afinidades de ligação reduzidas entre ACE2 e proteína spike SARS-CoV e influenciar negativamente o início da infecção SARS-CoV. Uma vez que a biossíntese, processamento, modificação de Golgi e oligomerização da proteína spike recém-sintetizada não foram afetados de forma apreciável pelas concentrações de anti-SARS-CoV de cloroquina ou NH 4Cl, concluímos que esses eventos ocorrem na célula independentemente da presença das drogas. A contribuição potencial dessas drogas na elevação do pH endossomal e seu impacto na entrada ou saída subsequente do vírus não pode ser descartada. Uma diminuição na transdução do pseudótipo SARS-CoV na presença de NH 4 Cl foi observada e foi atribuída ao efeito no pH intracelular [ 17 , 18 ]. Quando cloroquina ou NH 4 Cl são adicionados após a infecção, esses agentes podem elevar rapidamente o pH e subverter os eventos de fusão em andamento entre o vírus e os endossomos, inibindo assim a infecção.
Além disso, o mecanismo de ação do NH 4 Cl e da cloroquina pode depender de quando foram adicionados às células. Quando adicionados após o início da infecção, esses medicamentos podem afetar a fusão mediada pelo endossomo, a replicação subsequente do vírus ou a montagem e liberação. Estudos anteriores da cloroquina demonstraram que ela tem múltiplos efeitos nas células de mamíferos, além da elevação do pH endossomal, incluindo a prevenção da glicosialização terminal de imunoglobulinas [ 22 ]. Quando adicionada às células infectadas por vírus, a cloroquina inibiu os estágios posteriores da maturação do vírus da estomatite vesicular ao inibir a expressão da glicoproteína na superfície celular [ 23], e inibiu a produção de partículas infecciosas de HIV-1 interferindo com a glicosilação terminal da glicoproteína [ 24 , 25 ]. Com base nessas propriedades, sugerimos que a expressão da superfície celular de ACE2 subglicosilada e sua baixa afinidade para a proteína spike SARS-CoV pode ser o mecanismo primário pelo qual a infecção é evitada pelo pré-tratamento com drogas das células antes da infecção. Por outro lado, a rápida elevação do pH endossomal e a anulação da fusão vírus-endossoma podem ser o mecanismo primário pelo qual a infecção por vírus é evitada em condições pós-tratamento. Serão realizados ensaios mais detalhados de ligação de SARS CoV spike-ACE2 na presença ou ausência de cloroquina para confirmar nossos achados. Nossos estudos indicam que o impacto do NH 4O Cl e a cloroquina no ACE2 e os perfis de proteína de pico são significativamente diferentes. NH 4 Cl exibe um efeito mais pronunciado do que a cloroquina na glicosilação terminal, destacando as novas e intrincadas diferenças entre a cloroquina e o cloreto de amônio em afetar o transporte de proteínas ou glicosilação da proteína spike SARS-CoV e seu receptor, ACE2, apesar de sua similaridade bem estabelecida efeitos da elevação do pH endossômico.
A infecciosidade de coronavírus diferentes do SARS-CoV também é afetada pela cloroquina, como exemplificado pelo CoV-229E humano [ 15 ]. Os efeitos inibitórios observados na infectividade do SARS-CoV e na disseminação celular ocorreram na presença de 1–10 μM de cloroquina, que são concentrações plasmáticas atingíveis durante a profilaxia e tratamento da malária (variando de 1,6–12,5 μM) [ 26 ] e, portanto, estão bem tolerado pelos pacientes. Especulou-se recentemente que a cloroquina pode ser eficaz contra a SARS e os autores sugeriram que este composto pode bloquear a produção de TNFα, IL6 ou IFNγ [ 15 ]. Nossos dados fornecem evidências para a possibilidade de usar a droga bem estabelecida cloroquina no manejo clínico da SARS.
Conclusão
A cloroquina, um medicamento relativamente seguro, eficaz e barato usado para tratar muitas doenças humanas, incluindo malária, amebiose e vírus da imunodeficiência humana, é eficaz na inibição da infecção e propagação do CoV da SARS em cultura de células. O fato de a droga ter efeito antiviral inibitório significativo quando as células suscetíveis foram tratadas antes ou depois da infecção sugere um possível uso profilático e terapêutico.
Métodos
Infecção por SARS-CoV, imunofluorescência e análises de imunoprecipitação
As células Vero E6 (uma linha celular de rim de macaco verde africano) foram infectadas com SARS-CoV (cepa Urbani) em uma multiplicidade de infecção de 0,5 por 1 h. As células foram lavadas com PBS e depois incubadas em meio OPTI-MEM (Invitrogen) com ou sem várias concentrações de cloroquina ou NH 4 Cl (ambos da Sigma). A coloração por imunofluorescência foi realizada com fluido ascítico hiperimune de camundongo específico para SARS-CoV (HMAF) [ 8 ] seguido por anticorpo anti-camundongo acoplado a fluoresceína.
Dezoito horas após a infecção, os sobrenadantes contendo vírus foram removidos e as células foram pulsadas com 35 S- (Cys) por 30 min e perseguidas por 3 h antes da lise em tampão RIPA. Os lisados celulares clarificados e os meios foram incubados com HMAF, e as proteínas imunoprecipitadas foram separadas por gel NuPAGE de 3–8% (Invitrogen); as proteínas foram visualizadas por autorradiografia. Em alguns experimentos, as células foram perseguidas por 3 h com meio isento de isótopos. Os sobrenadantes celulares clarificados também foram imunoprecipitados com HMAF específico para SARS-CoV.
Análise de citometria de fluxo ACE2 e biossíntese
As células Vero E6 foram semeadas em meio Eagle modificado por Dulbecco (Invitrogen) suplementado com soro fetal bovino a 10%. No dia seguinte, as células foram incubadas em Opti-MEM (Invitrogen) na presença ou ausência de 10 μM de cloroquina ou 20 mM de NH 4 Cl. Para analisar os níveis de ACE2 na superfície celular, as células foram incubadas em gelo com 10 μg / mL de anticorpo anti-ACE2 de cabra purificado por afinidade (R&D Systems) e, em seguida, incubadas com anticorpo IgG suíno anti-cabra marcado com FITC (Caltag Laboratories) . As células marcadas foram analisadas por citometria de fluxo com um citômetro de fluxo FACSCalibur (BD Biosciences). Para estudos de biossíntese de ACE2, células Vero E6 foram pulsadas com 250 μCi 35 S- (Met) (Perkin Elmer) por 3 h com as concentrações indicadas de cloroquina ou NH 4Cl e então lisado em tampão RIPA. Os lisados clarificados foram imunoprecipitados com um anticorpo anti-ACE2 de cabra purificado por afinidade (sistemas R&D), e as proteínas imunoprecipitadas foram separadas por eletroforese em gel de SDS-poliacrilamida.
Referências
1
Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S, Tong S, Urbani C, Comer JA, Lim W, Rollin PE, Dowell SF, Ling AE, Humphrey CD, Shieh WJ, Guarner J, Paddock CD , Rota PB, Campos B, DeRisi J, Yang JY, Cox N, Hughes J, LeDuc JW, Bellini WJ, Anderson LJ, Grupo de Trabalho SARS: Um novo coronavírus associado à síndrome respiratória aguda grave. N Engl J Med 2003, 348: 1953-1966. 10.1056 / NEJMoa030781
CAS Artigo PubMed Google Scholar
2
Marra MA, Jones SJ, Astell CR, Holt RA, Brooks-Wilson A, Butterfield YS, Khattra J, Asano JK, Barber SA, Chan SY, Cloutier A, Coughlin SM, Freeman D, Girn N, Griffith OL, Leach SR, Mayo, McDonald H, Montgomery SB, Pandoh PK, Petrescu AS, Robertson AG, Schein JE, Siddiqui A, Smailus DE, Stott JM, Yang GS, Plummer F, Andonov A, Artsob H, Bastien N, Bernard K, Booth TF, Bowness D, Czub M, Drebot M, Fernando L, Flick R, Garbutt M, Gray M, Grolla A, Jones S, Feldmann H, Meyers A, Kabani A, Li Y, Normand S, Stroher U, Tipples GA, Tyler S , Vogrig R, Ward D, Watson B, Brunham RC, Krajden M, Petric M, Skowronski DM, Upton C, Roper RL: A sequência do genoma do coronavírus associado a SARS. Science 2003, 300: 1399-1404. 10.1126 / science.1085953
CAS Artigo PubMed Google Scholar
3 -
Rota PA, Oberste MS, Monroe SS, Nix WA, Campagnoli R, Icenogle JP, Penaranda S, Bankamp B, Maher K, Chen MH, Tong S, Tamin A, Lowe L, Frace M, DeRisi JL, Chen Q, Wang D , Erdman DD, Peret TC, Burns C, Ksiazek TG, Rollin PE, Sanchez A, Liffick S, Holloway B, Limor J, McCaustland K, Olsen Rasmussen M, Fouchier R, Gunther S, Osterhaus AS, Drosten C, Pallansch MA, Anderson LJ, Bellini WJ: Caracterização de um novo coronavírus associado à síndrome respiratória aguda grave. Science 2003, 300: 1394-1399. 10.1126 / science.1085952
CAS Artigo PubMed Google Scholar
4 -
Ng ML, Tan SH, Ver EE, Ooi EE, Ling AE: Proliferative growth of SARS coronavirus in Vero E6 cells. J Gen Virol 2003, 84: 3291-3303. 10.1099 / vir.0.19505-0
CAS Artigo PubMed Google Scholar
5
Li M, Moore WJ, Vasilieva N, Sui J, Wong SK, Berne MA, Somasundaran M, Sullivan JL, Luzuriaga K, Greenough TC, Choe H, Farzan M: A enzima de conversão de angiotensina 2 é um receptor funcional para o coronavírus SARS. Nature 2003, 426: 450-454. 10.1038 / nature02145
CAS Artigo PubMed Google Scholar
6
Bergeron E, Vincent MJ, Wickham L, Hamelin J, Basak A, Nichol ST, Chrétien M, NG Seidah: Implicação de convertases de pró-proteína no processamento e disseminação de coronavírus da síndrome respiratória aguda grave. Biochem Biophys Res Comm 2005, 326: 554-563. 10.1016 / j.bbrc.2004.11.063
CAS Artigo PubMed Google Scholar
7
Zhang Y, Li T, Fu L, Yu C, Li Y, Xu X, Wang Y, Ning H, Zhang S, Chen W, Babiuk LA, Chang Z: Silenciando a expressão da proteína spike SARS-CoV em células cultivadas por interferência de RNA. FEBS Lett 2004, 560: 141-146. 10.1016 / S0014-5793 (04) 00087-0
CAS Artigo PubMed Google Scholar
8
Subbarao K, McAuliffe J, Vogel L, Fahle G, Fischer S, Tatti K, Packard M, Shieh WJ, Zaki S, Murphy B: A infecção prévia e a transferência passiva de anticorpo neutralizante impedem a replicação do coronavírus da síndrome respiratória aguda grave no trato respiratório de ratos. J Virol 2004, 78: 3572-3577. 10.1128 / JVI.78.7.3572-3577.2004
PubMed Central CAS Artigo PubMed Google Scholar
9
Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K, Nabel GJ: Uma vacina de DNA induz a neutralização do coronavírus SARS e imunidade protetora em camundongos. Nature 2004, 428: 561-564. 10.1038 / nature02463
CAS Artigo PubMed Google Scholar
10
Bisht H, Roberts A, Vogel L, Bukreyev A, Collins PL, Murphy BR, Subbarao K, Moss B: A proteína de pico de coronavírus da síndrome respiratória aguda grave expressa pelo vírus vaccinia atenuado imuniza de forma protetora os ratos. Proc Natl Acad Sci USA 2004, 101: 6641-6646. 10.1073 / pnas.0401939101
PubMed Central CAS Artigo PubMed Google Scholar
11
Bukreyev A, Lamirande EW, Buchholz UJ, Vogel LN, Elkins WR, St. Claire M, Murphy BR, Subbarao K, Collins PL: Imunização mucosa de macacos verdes africanos (Cercopithecus aethiops) com um vírus de parainfluenza atenuado que expressa o pico de proteína do coronavírus SARS para a prevenção da SARS. Lancet 2004, 363: 2122-2127. 10.1016 / S0140-6736 (04) 16501-X
CAS Artigo PubMed Google Scholar
12
Sainz B Jr, Mossel EC, Peters CJ, Garry RF: Interferon-beta e interferon-gama inibem sinergicamente a replicação do coronavírus associado à síndrome respiratória aguda grave (SARS-CoV). Virology 2004, 329: 11-17. 10.1016 / j.virol.2004.08.011
CAS Artigo PubMed Google Scholar
13
Stroher U, DiCaro A, Li Y, Strong JE, Aoki F, Plummer F, Jones SM, Feldmann H: O coronavírus relacionado à síndrome respiratória aguda grave é inibido pelo interferon-alfa. J Infect Dis 2004, 189: 1164-1167. 10.1086 / 382597
Artigo PubMed Google Scholar
14
Sui J, Li W, Murakami A, Tamin A, Matthews LJ, Wong SK, Moore MJ, Tallarico AS, Olurinde M, Choe H, Anderson LJ, Bellini WJ, Farzan M, Marasco WA: Neutralização potente da síndrome respiratória aguda grave ( SARS) coronavírus por um mAb humano à proteína S1 que bloqueia a associação do receptor. Proc Natl Acad Sci USA 2004, 101: 2536-2541. 10.1073 / pnas.0307140101
PubMed Central CAS Artigo PubMed Google Scholar
15
Savarino A, Boelaert JR, Cassone A, Majori G, Cauda R: Efeitos da cloroquina nas infecções virais: um medicamento antigo contra as doenças de hoje? Lancet Infect Dis 2003, 3: 722-727. 10.1016 / S1473-3099 (03) 00806-5
CAS Artigo PubMed Google Scholar
16
Ng ML, Tan SH, Veja EE, Ooi EE, Ling AE: Primeiros eventos de infecção por coronavírus SARS em células vero. J Med Virol 2003, 71: 323-331. 10.1002 / jmv.10499
CAS Artigo PubMed Google Scholar
17
Simmons G, Reeves JD, Rennekamp AJ, Amberg SM, Piefer AJ, Bates P: Caracterização de entrada viral mediada por glicoproteína de pico de coronavírus associado à síndrome respiratória aguda grave (SARS-CoV). Proc Natl Acad Sci USA 2004, 101: 4240-4245. 10.1073 / pnas.0306446101
PubMed Central CAS Artigo PubMed Google Scholar
18
Yang ZY, Huang Y, Ganesh L, Leung K, Kong WP, Schwartz O, Subbarao K, Nabel GJ: a entrada dependente do pH do coronavírus da síndrome respiratória aguda grave é mediada pela glicoproteína de pico e aumentada pela transferência de células dendríticas através de DC-SIGN . J Virol 2004, 78: 5642-5650. 10.1128 / JVI.78.11.5642-5650.2004
PubMed Central CAS Artigo PubMed Google Scholar
19
Tipnis SR, Hooper NM, Hyde R, Karran E, Christie G, Turner AJ: Um homólogo humano da enzima conversora de angiotensina. Clonagem e expressão funcional como uma carboxipeptidase insensível a captopril. J Biol Chem 2000, 275: 33238-33243. 10.1074 / jbc.M002615200
CAS Artigo PubMed Google Scholar
20
Song HC, Seo MY, Stadler K, Yoo BJ, Choo QL, Coates SR, Uematsu Y, Harada T, Greer CE, Polo JM, Pileri P, Eickmann M, Rappuoli R, Abrignani S, Houghton M, Han JH: Síntese e caracterização de uma forma oligomérica nativa de glicoproteína de pico de coronavírus da síndrome respiratória aguda grave recombinante. J Virol 2004, 78: 10328-10335. 10.1128 / JVI.78.19.10328-10335.2004
PubMed Central CAS Artigo PubMed Google Scholar
21
Keyaerts E, Vijgen L, Maes P, Neyts J, Ranst MV: In vitro inibição de coronavírus de síndrome respiratória aguda grave por cloroquina. Biochem Biophys Res Commun 2004, 323: 264-268. 10.1016 / j.bbrc.2004.08.085
CAS Artigo PubMed Google Scholar
22
Thorens B, Vassalli P: Cloroquina e cloreto de amônio previnem a glicosilação terminal de imunoglobulinas em células plasmáticas sem afetar a secreção. Nature 1986, 321: 618-620. 10.1038 / 321618a0
CAS Artigo PubMed Google Scholar
23
Dille BJ, Johnson TC: Inibição da expressão da glicoproteína do vírus da estomatite vesicular pela cloroquina. J Gen Virol 1982, 62: 91-103.
CAS Artigo PubMed Google Scholar
24
Tsai WP, Nara PL, Kung HF, Oroszlan S: Inibição de infectividade do vírus da imunodeficiência humana por cloroquina. AIDS Res Hum Retroviruses 1990, 6: 481-489.
CAS Artigo PubMed Google Scholar
25
Savarino A, Lucia MB, Rastrelli E, Rutella S, Golotta C, Morra E, Tamburrini E, Perno CF, Boelaert JR, Sperber K, Cauda RC: Efeitos anti-HIV da cloroquina: inibição da glicosilação de partículas virais e sinergismo com inibidores da protease . J Acquir Immune Defic Syndr 2004, 35: 223-232.
CAS Artigo PubMed Google Scholar
26
Ducharme J, Farinotti R: Clinical pharmacokinetics and metabolism of cloroquine. Concentre-se nos avanços recentes. Clin Pharmacokinet 1996, 31: 257-274.
CAS Artigo PubMed Google Scholar
Baixar referências
Reconhecimentos
Agradecemos a Claudia Chesley e Jonathan Towner pela leitura crítica do manuscrito. Este trabalho foi apoiado por uma concessão canadense PENCE (T3), concessão do grupo CIHR #MGC 64518 e concessão CIHR # MGP-44363 (para NGS).
Informação sobre o autor
Afiliações
Special Pathogens Brach, Divisão de Doenças Virais e Rickettsiais, Centros para Controle e Prevenção de Doenças, Atlanta, Geórgia, 1600 Clifton Road, 30333, EUA
Martin J Vincent, Bobbie R Erickson, Pierre E Rollin, Thomas G Ksiazek e Stuart T Nichol
Laboratório de Neuroendocrinologia Bioquímica, Instituto de Pesquisa Clínica de Montreal, Montreal, 110 Pine Ave West, QCH2W1R7, Canadá
Eric Bergeron, Suzanne Benjannet e Nabil G Seidah
autor correspondente
Correspondência para Stuart T Nichol .
Informação adicional
Interesses competitivos
O (s) autor (es) declaram não ter interesses conflitantes.
Contribuições dos autores
MV fez todos os experimentos relativos à infecção por SARS CoV e coordenou a redação do manuscrito. EB e SB realizaram experimentos na biossíntese de ACE2 e análise FACS. BE realizou a aquisição de dados dos experimentos de imunofluorescência. PR e TK forneceram reagentes essenciais e revisaram o manuscrito criticamente. NS e SN juntamente com MV e EB participaram do planejamento dos experimentos, revisão e interpretação dos dados e revisão crítica do manuscrito. Todos os autores leram e aprovaram o conteúdo do manuscrito.
Arquivos originais enviados pelos autores para imagens
Abaixo estão os links para os arquivos originais enviados pelos autores para imagens.
Arquivo original dos autores para a figura 1
Arquivo original dos autores para a figura 2
Arquivo original dos autores para a figura 3
Arquivo original dos autores para a figura 4
Arquivo original dos autores para a figura 5
Arquivo original dos autores para a figura 6
Direitos e permissões
Reimpressões e permissões
Sobre este artigo
Cite este artigo
Vincent, MJ, Bergeron, E., Benjannet, S. et al. A cloroquina é um inibidor potente da infecção e disseminação do coronavírus SARS. Virol J 2, 69 (2005). https://doi.org/10.1186/1743-422X-2-69
Baixar citação
Recebido12 de julho de 2005
Aceitaram22 de agosto de 2005
Publicados22 de agosto de 2005
DOIhttps://doi.org/10.1186/1743-422X-2-69
Nenhum comentário:
Postar um comentário